

从靶向治疗耐药机制到联合用药策略(下篇)
source link: https://kaopubear.top/blog/2023-01-18-mechanisms-of-resistance-2/
Go to the source link to view the article. You can view the picture content, updated content and better typesetting reading experience. If the link is broken, please click the button below to view the snapshot at that time.

从靶向治疗耐药机制到联合用药策略(下篇) | 思考问题的熊
从靶向治疗耐药机制到联合用药策略(下篇)
2023-01-18, 2017 words, 7 min read本文为熊言熊语邮件通讯会员计划内容的试读版,完整内容请点击通讯主页订阅并查看。
你好,我是思考问题的熊,本内容是参加会员计划读者的专属内容,感谢你通过会员计划支持我持续创作。展信佳~
马上就是农历新年,本期内容是虎年最后一期会员计划推送,再见面就是兔年。提前祝你新年快乐。
本期内容:
在第12期熊言熊语plus内容中我们一起学习了「从靶向治疗耐药机制到联合用药策略」的前半部门内容。
针对耐药机制,我们说靶向药物的耐药可以分为原发性耐药和继发性耐药,其中继发性耐药又可以划分为遗传机制和非遗传机制。此外,越来越多的研究发现肿瘤的瘤内异质性也是耐药重要原因。
而联合治疗策略便是针对上述不同耐药机制展开的,在今天第14期plus内容中,我们将一起完成下半部分的学习。
下期预告:
如果在过年期间,我没有看到特别有意思的内容想要插队和你分享,下期我们将正式开启「生物标志物」系列内容的更新。生物标志物有不同的维度,大到基因组本身的不稳定性,小到一个基因的点突变。在第一期「生物标志物」内容中,我们将会一起学习基因组不稳定性的衡量指标之一:同源重组修复缺陷(HRD)。
以下为本期内容正文,约7000字。
克服原发性耐药
在这个系列文章的上篇中,我们提到:
理解内在耐药性的机制,重要的是要认识到正常的细胞平衡在很大程度上取决于信号通路之间和内部的相互影响和反馈调节。比如为了维持平衡状态,对一条信号通路的抑制往往会导致第二条通路(或同一条通路)的补偿性增强。这种缓冲作用确保了生物系统的稳健性,但在癌症治疗中就变成了一个重大挑战。
既然一种信号通路的抑制会被另一种信号的激活所补偿,那么一个或许可行的思路就是同时抑制这两条通路。
因为BRAF突变的CRC对BRAF抑制剂存在原发性耐药的情况,2012年先后有两篇发表Nature和Cancer Discovery的文章想要探索可以和BRAF抑制剂协同作用的其它激酶。
前者通过RNAi的基因编辑方法,在BRAF V600E 突变的细胞中,抑制了518个激酶和17个额外的激酶相关基因。研究结果现实,通过西妥昔单抗或小分子药物如吉非替尼或厄洛替尼对EGFR的抑制与BRAF(V600E)的抑制在体外和体内都具有强烈的协同作用。从机制上讲,BRAF(V600E)抑制会导致EGFR的快速反馈激活,从而使癌细胞继续增殖,而黑色素瘤细胞因为表达低水平的EGFR,因此和结直肠癌不同不会受这种反馈激活的影响。
在经过临床试验验证后,BRAF和EGFR抑制剂的联合治疗现被批准用于BRAF突变型结肠癌。
在上期文章中,我们也提到了合成致死原理。这一应用于描述基因之间相互左右的概念,后来也被广泛的用来描述基因药物相互作用(如BRCA+PARPi)或者药物和药物的相互作用。
这类合成致死性基因筛选方法可以在一种药物在大多数患者中没有产生临床反应的情况下开展实验,尤其是随着CRISPR-Cas9技术的成熟。
肝癌的主要基因突变如TP53、CTNNB1、TERT启动子等突变缺乏成药性(undrugable),无法直接作为有效药物靶点。目前,肝癌一线靶向药物仑伐替尼和索拉非尼、二线靶向药物瑞戈非尼等均为多激酶靶点药物,临床疗效远未达到期望值。
例如,在肝癌的一线治疗中,可以同时抑制抑制血管内皮生长因子受体(VEGFR 1-3)、成纤维细胞生长因子受体(FGFR1-4)、血小板衍生生长因子受体a(PDGFRa)、KIT和RET的多激酶抑制剂仑伐替尼(Lenvatinib)仅仅能让约五分之一的患者临床获益。
为了确定能与仑伐替尼协同作用的药物靶点,2021年发表在Nature的一项研究中,研究人员进行了CRISPR-Cas9合成致死性筛选,以剖析对仑伐替尼的耐药机制,确定了EGFR TKI 与仑伐替尼在肝癌中的合成致死性。随后的I期临床试验中,仑伐替尼和吉非替尼的组合被证明对仑伐替尼耐药的肝细胞癌患者是安全和潜在有效。
克服获得性耐药性
在上篇内容中,我们提到获得性耐药性最常见的形式之一是药物靶点本身的二次突变。这种类型的耐药性最容易通过设计对这些变异靶点有活性的下一代抑制剂来克服,例如三代EGFR抑制剂Osimertinib,它能有效抑制一代EGFR TKI治疗时经常出现的T790M突变,并因此使患者的临床获益增加一倍。
双重阻断(Double blockade)
但更具挑战性的情况是治疗获得了上游或下游激活性突变而对关键致癌信号通路的抑制产生耐药的情况。
在BRAF突变的黑色素瘤中,MAPK通路的重新激活是最主要的获得性BRAF抑制剂耐药机制,这导致了临床研究使用MAPK途径的垂直双阻断来避免这种重激活。逻辑类似下图。
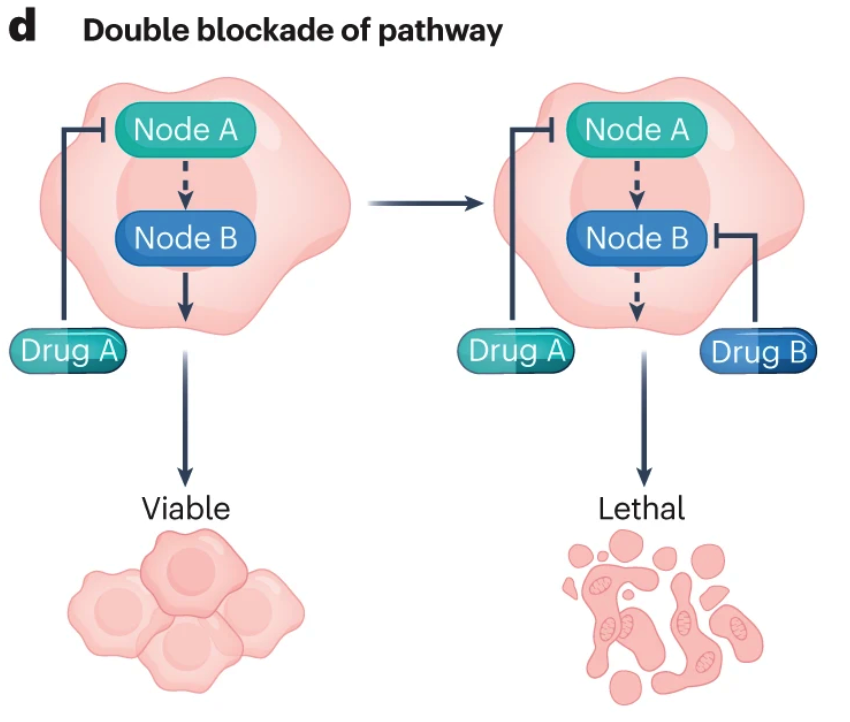
事实上,BRAF和MEK抑制剂的组合结果优于单独的BRAF抑制,现在是BRAF突变黑色素瘤的标准治疗方法。
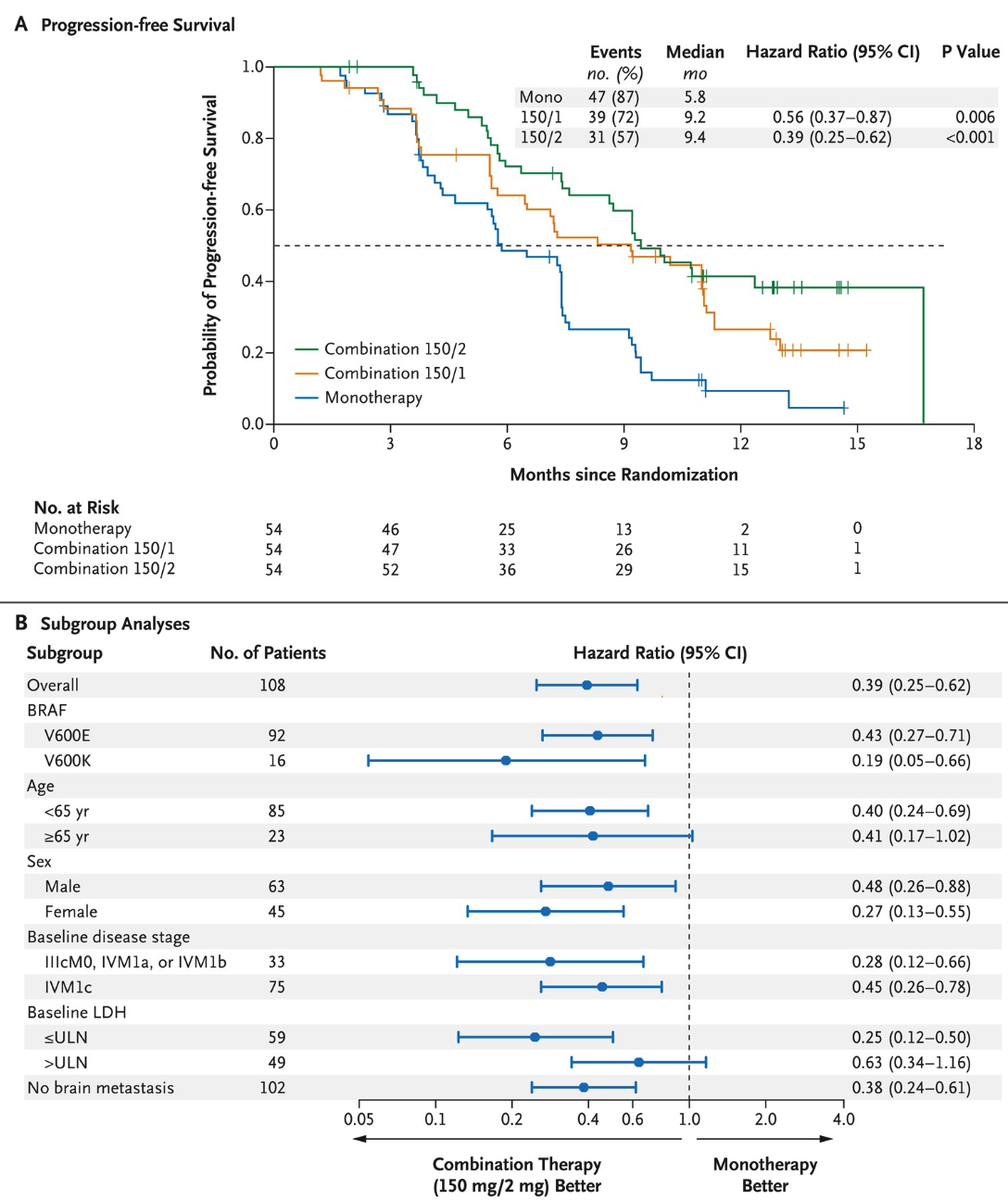
2015年发表在NEJM的一篇临床研究,探索了BRAF和MEK抑制剂联合使用对于BRAF V600 突变的黑色素瘤患者的疗效。
该研究将入组患者分为三组,其中一组仅使用达拉菲尼 (Dabrafenib),另外两组分别配合不同剂量的曲美替尼 (Trametinib)。结果显示,联合治疗的效果要远好于单独治疗。
KRAS G12C 抑制剂无疑是2022年最引人瞩目的靶向治疗药物,但是最近关于选择性KRAS G12C 抑制剂有效性的研究也呼应了我们今天的耐药和联合治疗话题。
KRAS G12C 抑制剂在临床上显示出不同的结果,总的来说,KRAS G12C 突变的NSCLC患者获益处远大于携带相同KRAS基因突变的CRC患者。
我曾经在2022年ESMO会议的时候碰巧感慨发了一个朋友圈,说的就是这个事情。

KRAS G12C 突变的结肠癌,CodeBreak 101 和 KRYSTAL-1 都表明无论是Sotorasib 还是 Adagrasib 加上 EGFR 单抗效果都要更好。
多节点抑制(Multi-node inhibition)
如果两种药物联合使用更好,那么在同一通路中使用三种或更多的药物联合是否可行呢?
🍺🍺试读结束🍺🍺
剩余内容是参加会员计划读者的专属内容
欢迎你通过会员计划支持我持续创作
如果你对这篇文章感兴趣,欢迎通过邮箱或者微信订阅我的 「熊言熊语」会员通讯,我将第一时间与你分享肿瘤生物医药领域最新行业研究进展和我的所思所学所想,点此链接即可进行免费订阅。
· 分享链接 https://kaopubear.top/blog/2023-01-18-mechanisms-of-resistance-2/
Recommend
About Joyk
Aggregate valuable and interesting links.
Joyk means Joy of geeK