

皮肤微生物与人体健康:是敌是友?
source link: https://www.huxiu.com/article/516619.html?f=rss
Go to the source link to view the article. You can view the picture content, updated content and better typesetting reading experience. If the link is broken, please click the button below to view the snapshot at that time.

皮肤微生物与人体健康:是敌是友?
人体皮肤上栖息着各种细菌、真菌、病毒,还有螨虫等小型节肢动物,它们的集合形成皮肤微生物组或皮肤菌群。皮肤微生物组与皮肤表面的细胞、汗液、皮脂等物质,以及外界环境共同组成一个生态系统,对于维持宿主皮肤健康有重要作用。
本文来自微信公众号:科学杂志1915(ID:kexuemag),作者:夏晶晶 钟倩 魏情珍 王久存,原文标题:《皮肤上的“生态系统”:皮肤微生物组》,题图来自:视觉中国
人类基因组计划在2003年完成以后,科学家意识到解密人类自身基因组并不能完全解决疾病与健康的关键问题。人体表面和体内存在着数量巨大的共生微生物,它们与人体细胞数量大致相当,但其基因总数庞大,可达人类基因数目的几百倍,而人类却对这些共生微生物知之甚少。鉴于此,美国国立卫生研究院(NIH)于2007年底率先启动 “人类微生物组计划”(Human Microbiome Project, HMP),包括中国在内的十余个国家共同参与了这一国际大科学计划。
该研究计划使用新一代测序技术对人体多个部位的共生微生物进行宏基因组测序,宏基因组测序是指对微生物群体进行高通量测序,分析特定环境中微生物群体的基因组成及功能、微生物群体的多样性与丰度,进而分析微生物与环境、微生物与宿主之间的关系,发现具有特定功能的基因。
HMP的目标是通过绘制人体共生微生物的宏基因组图谱,解析微生物对人类健康的影响。现在知道人体所有与外界环境有交流的器官,从口腔到肠道、从鼻腔到肺、男女生殖—泌尿系统、皮肤表面等,都有大量微生物的定殖(colonization),即来自不同环境的微生物黏附在人体特定部位,进行生长、繁殖,它们形成大大小小、环境各异的“生态系统”,其组成和丰度均有显著差异。
在如此多理化特征相差巨大的“生态系统”中,皮肤位于人体最外层,与外界环境接触面积大、接触时间长。那么这个“生态系统”,即“皮肤微生态”有哪些特征,与人体健康有怎样的关联,又与皮肤的日常维护有什么关系。
一、皮肤微生物与人体健康
皮肤微生物组(skin microbiota)对于维持宿主皮肤稳态、发挥皮肤的屏障功能有重要作用 [1]。
抵抗病原微生物侵袭
皮肤上共生微生物的存在会导致其对皮肤上营养和空间的竞争,从而极大地影响病原微生物进入皮肤表面。这些常驻微生物可以直接或通过调控皮肤的角质形成细胞而间接分泌抗菌肽,以抵御外界病原菌定殖;还可分解角质细胞碎屑或脂质,辅助乳化皮脂膜,维持表皮酸性环境,以抵御外界病原菌定殖。
参与宿主免疫反应
皮肤常驻微生物与宿主之间不仅存在共生关系,还能激发宿主适当的保护性免疫反应,使宿主更强有力地对抗病原体的感染。在成年小鼠皮肤中,微生物的定殖可调控局部炎症环境和免疫细胞的功能 [3,4]。例如,无菌小鼠感染寄生病原体利什曼原虫会导致寄生虫的疯狂生长和小鼠保护性免疫反应减弱,但随着表皮葡萄球菌在无菌小鼠表面的定殖,这些不良反应会有所缓解。
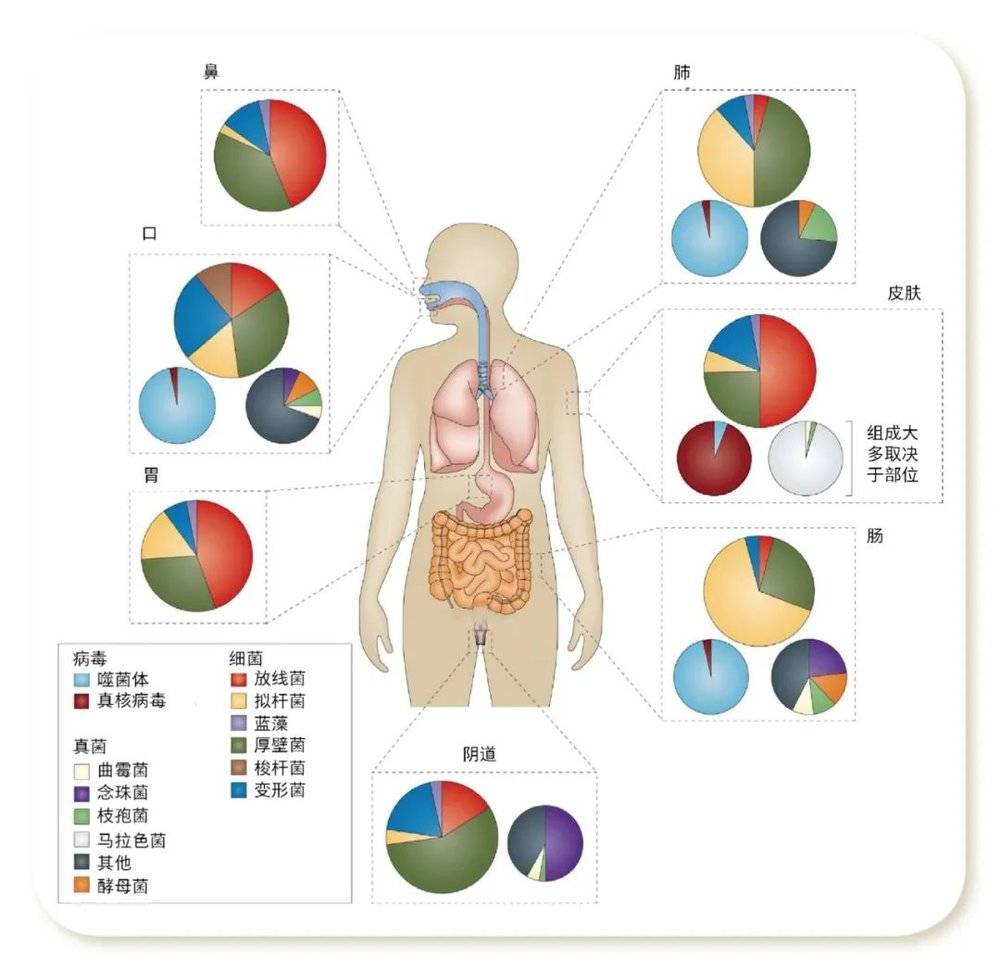
人体共生微生物的分布特征 [2]
维持表皮正常结构
通过对无菌小鼠和有菌小鼠背部皮肤的转录组学分析,发现差异表达基因功能除富集于免疫反应外,主要富集于表皮增殖与分化;小鼠皮肤组织染色实验,亦进一步表明皮肤菌群对表皮增殖与分化有重要调节作用。
调节皮肤的损伤修复与再生
皮肤微生物组在皮肤修复和再生中发挥了重要作用。通过测试不同细菌负载下小鼠皮肤创面诱导毛囊新生的状况,发现小鼠创面诱导毛囊新生能力与皮肤细菌数量呈正相关:无菌小鼠修复再生能力最低,而野生型小鼠最高 [5];而人体实验中局部使用广谱抗生素会减缓人体皮肤伤口愈合。
生成活性代谢物调节皮肤健康
皮肤微生物组在皮肤表面合成具有活性的代谢产物,如短链脂肪酸、B族维生素等,调节皮肤生理功能。越来越多的研究显示细菌代谢产物是菌群发挥生物学作用的重要组分,如某些细菌的色氨酸代谢产物吲哚-3-甲醛在特应性皮炎患者皮肤表面的含量会升高,吲哚-3-甲醛可激活芳香烃受体对朗格汉斯细胞产生负向调节作用,参与调节皮肤炎症。
皮肤表面部分微生物能分解皮脂腺分泌的皮脂,产生游离脂肪酸,降低皮肤表面酸碱度,并与皮脂细胞来源的导管素、β-防御素和抗菌组蛋白共同控制微生物的定殖。皮肤上的顶泌汗腺能将其分泌物,由蛋白质、脂质和类固醇混合而成的油性、无味混合物,分泌到毛囊中,被常驻微生物降解,产生汗水的特征气味。
我们通过宏基因组学研究,发现丰度最高的基因参与辅助因子和维生素的生物合成,这不仅对微生物的生长和生存至关重要,维生素的合成亦与皮肤健康紧密相关。比如在皮肤微生物组中发现的生物活性分子依克多因(ectoine)已应用于美白抗衰。
肠道微生物研究对皮肤微生物研究的启发
肠道微生物(又称肠道菌群)与宿主的相互作用研究较为广泛和深入,可为皮肤菌群对宿主的作用研究带来启发。肠道微生物与宿主的作用并非单方向单线程:微生物对宿主产生的效应可改变宿主表型,同时新的宿主表型又反过来对微生物菌群产生反馈效应。
如宿主饮食习惯及异源物质摄入(如药物)可对肠道微生物的组成、基因表达产生影响,而肠道菌群代谢产物,如短链脂肪酸、氨基酸及其衍生物等可被宿主肠道吸收入血液,影响宿主多器官生理、病理等过程。这些代谢产物既能促进健康,也可能损害健康。微生物菌群及其宿主共同进化,可影响宿主,产生新的表型。
二、影响皮肤微生物组构成的因素
对于同一个体,皮肤微生物组具有时空稳定性;另一方面,皮肤微生物又极具个体差异性,多种内源或外源因素可对皮肤微生物造成影响,包括皮肤部位、皮肤腺体及相关理化性质、性别、年龄、地理位置和种族、环境暴露或污染等。
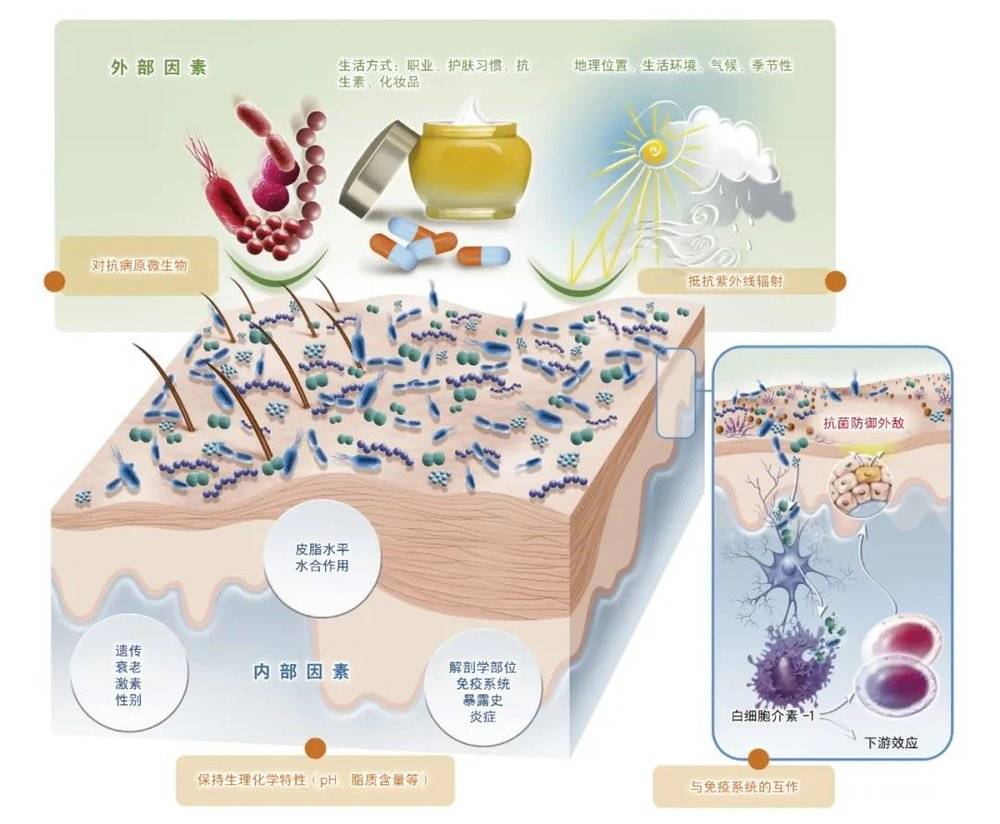
影响皮肤菌群的因素 [6]
根据不同皮肤部位的水油特性,皮肤主要分为油性、湿性、干性部位及足部。油性部位主要富集丙酸杆菌和马拉色菌,湿性部位以丙酸杆菌和葡萄球菌为主。油性部位的微生物组成较稳定,而干性部位的微生物组成随时间变化显著。
皮肤腺体及相关理化性质
不同部位皮肤“零件”(如毛囊、汗腺、皮脂腺等)的差异造就了皮肤各自独特的理化性质,如脂肪酸组成、酸碱度等,它们对生存其上的微生物产生了较大影响。
外泌汗腺通过分泌汗液影响皮肤酸碱度,影响微生物的定殖。皮脂腺与毛囊相连,能分泌富含脂质的油脂,在润滑皮肤的同时发挥抗菌作用。皮脂腺相对缺氧,支持兼性厌氧菌的生长,如痤疮丙酸杆菌(Cutibacterium acnes)能把皮脂中的甘油三酯水解成游离脂肪酸,游离脂肪酸有助于维持皮肤的酸性,从而抑制许多常见病原菌。
由于自身生理因素(激素、皮脂、出汗率、皮肤厚度和毛发密度等)的差异和后天生活习惯(洗手频率、护肤习惯)的不同,男性和女性的皮肤微生物组也有显著差异。
婴儿皮肤微生物的定殖取决于分娩方式和母亲的皮肤菌群,但青春期时皮肤微生物会重新调整。青春期激素的增加可刺激产生大量油脂,有利于亲脂性微生物的生长,如丙酸杆菌属和马拉色菌属,因此青春期的皮肤菌群容易失衡而导致痤疮等皮肤问题。青春期过后,皮肤菌群会重新恢复到相对稳定的状态。随着年龄增加,皮肤呈现老化特征,如色斑变多,皮肤变黄,皱纹变多,表皮厚度增加,气味生成等,这些都与皮肤微生物密切相关。
地理位置和种族
来自不同国家地区、种族甚至海拔的人群的皮肤微生物组也不尽相同。我们近期一项研究发现,中国人群及新加坡人群皮肤中富集一种微生物——奥斯陆莫拉菌(Moraxella osloensis),但它在北美人群中较少出现。
皮肤是人体与外界环境接触面积最大、接触时间最长的器官,环境中的颗粒物和生物成分对皮肤微生态的影响最显而易见。例如,多环芳烃作为一种环境污染物,可导致面部老化、内分泌失调,长期暴露会导致皮肤微生物菌群结构发生变化。
三、皮肤微生态失衡会导致皮肤疾病
越来越多的研究表明,皮肤微生态失衡(又称菌群失衡)会导致一系列皮肤疾病,如特应性皮炎、痤疮、脂溢性皮炎、银屑病、机会性感染等 [7]。
特应性皮炎与金黄色葡萄球菌
特应性皮炎是一种慢性复发性皮肤疾病,多在儿童期发病,患病率可高达20%,表现为剧烈瘙痒,严重影响患者生活质量。90%以上的患者在病变和非病变皮肤上都定殖了金黄色葡萄球菌,而在健康个体中该菌的定殖比例低于5%,当患者病情好转时金黄色葡萄球菌的相对丰度就有所降低。
痤疮与痤疮丙酸杆菌
许多人在青春期受到过“青春痘”的困扰,“青春痘”就是痤疮,是一种最常见的皮肤病。痤疮可影响多达80%的青少年,并持续存在于约3%的中年人中。痤疮的致病因素主要涉及四个方面:皮脂分泌增加、滤泡表皮过度角质化、痤疮丙酸杆菌定殖和炎症 [8]。在健康人和痤疮患者都有痤疮丙酸杆菌的定殖,但痤疮丙酸杆菌的基因表达谱在两类人群中存在显著差别,且不同痤疮丙酸杆菌菌株有不同的毒力,在健康皮肤和痤疮患者皮损中的分布和丰度也不同,如痤疮丙酸杆菌的亚种 1A1 型与痤疮相关。

健康个体和痤疮患者鼻部毛囊皮脂腺单元内各种痤疮丙酸杆菌菌株的分布 [9] (a)健康个体中各亚型菌株的正常相对丰度;(b)痤疮患者的痤疮丙酸杆菌菌群失调:有些亚型相对丰度低,有些亚型的相对丰度高;(c)某些痤疮丙酸杆菌可在不同部位(如皮肤表层、皮脂腺、毛囊)形成生物膜,导致痤疮“经久不消”,并对部分抗生素产生耐药性。
脂溢性皮炎与马拉色菌
脂溢性皮炎是一种炎症性、增生性、瘙痒性皮肤病,特征是皮肤发红并呈片状,通常会影响头皮。以真菌为靶点的抗菌药物能有效对抗脂溢性皮炎,而抗细菌药物则不能缓解疾病发生,马拉色菌属作为皮肤真菌的主要组成部分,广泛存在于头皮部位,推测马拉色菌属参与了疾病的发生。已发现脂溢性皮炎的改善与头皮上马拉色菌减少有关。推测疾病发生与马拉色菌的脂肪酶基因相关,该酶能降解皮脂产生的游离脂肪酸代谢物(如油酸),而这些代谢物可渗透至皮肤上层,促进皮肤过度增生和发生炎症。
银屑病是一种免疫介导的炎症性皮肤病,全球有1%~3%人口受到影响。以往研究表明,皮肤微生物群落的生态失衡与多种炎症和自身免疫性疾病有关。有研究表明,银屑病患者皮肤上的微生物群落与健康皮肤上的有很大不同,银屑病皮肤微生物组的多样性增加,但稳定性降低。群落稳定性的丧失及表皮葡萄球菌和痤疮丙酸杆菌等免疫调节细菌的减少,可能导致金黄色葡萄球菌等病原体的定殖增多,加剧皮肤炎症。
机会性感染
尽管皮肤共生微生物通常和平地栖息在宿主体内,但许多微生物在特定环境下具有引起感染的能力。表皮葡萄球菌具有许多有益作用,但它仍是感染的常见原因,尤其是涉及留置医疗器械(如导管)的院内深部组织感染。此外,在正常皮肤微生物组中发现的许多细菌经常导致慢性、不愈合伤口感染,通常发生在糖尿病患者和老年人中。
四、皮肤型
皮肤微生态具有极大的个体差异性。基于北美人群及中国汉族人群的大规模宏基因组学研究,均提示皮肤微生物组具有极强的个体差异性,即人与人之间的皮肤微生物组成差异性极大,甚至有人提出“皮肤微生物指纹”的概念。
面对如此复杂的多样性,如何实现个性化精准干预?我们从“肠道菌群”研究中找到了“灵感”——群体分型(stratification)。皮肤菌群和肠道菌群一样,都是不可见且不能被传统方法测量的新兴表型,通过研究分析多个表型数据的集合(表型组),可有效描述微生物群落结构的主要特征,并对临床有积极指导作用。
研究发现,皮肤微生物在中国人群的群体水平存在两种稳定的群落组成模式,命名为“皮肤型”(cutotypes),分别是以奥斯陆莫拉菌为主导的M型皮肤(M-cutotype)和以痤疮丙酸杆菌为主导的C型皮肤(C-cutotype) [10]。
两种皮肤型具有不同的微生物网络特征和基因功能富集:C型皮肤微生物群落富集碳水化合物和甾醇代谢、脂肪酸合成等,M型皮肤微生物富集氨基酸、芳香族化合物代谢、耐药性等;宿主皮肤状态也显示出明显差异,C型皮肤水分油脂含量高,以年轻人居多,M型皮肤水分油脂含量偏低,肤色暗沉偏黄,以老年人居多。
两种“皮肤型”好似两个相对独立的微生物稳态,如果通俗地类比于其他“生态系统”:即是不同 “土壤”(皮肤型)选择了适合各自生长的“植被”(微生物),这些植被又可反过来影响土壤状态。自此,可以清楚地看到“相互适应、精准匹配”对于皮肤上“生态系统”和谐发展非常重要。
基于皮肤型这一新的分型方式,将大大简化微生物个体差异性的评估,方便人们抓住核心问题的主要差异特征,进而实现潜在的个性化诊断和精准干预。
参考资料:
1.Chen Y E, Fischbach M A, Belkaid Y. Skin microbiota-host interactions. Nature, 2018, 553: 427-436.
2.Marsland B J, Gollwitzer E S. Host-microorganism interactions in lung diseases. Nat Rev Immunol, 2014, 14: 827-835.
3.Naik S, Bouladoux N, Wilhelm C, et al. Compartmentalized control of skin immunity by resident commensals. Science, 2012, 337: 1115-1119.
4.Naik S, Bouladoux N, Linehan J L, et al. Commensal-dendritic-cell interaction specifies a unique protective skin immune signature. Nature, 2015, 520: 104-108.
5.Wang G, Sweren E, Liu H, et al. Bacteria induce skin regeneration via IL-1beta signaling. Cell Host Microbe, 2021, 29: 777-791.
6.Boxberger M, Cenizo V, Cassir N, et al. Challenges in exploring and manipulating the human skin microbiome. Microbiome, 2021, 9: 125-139.
7.Byrd A L, Belkaid Y, Segre J A. The human skin microbiome. Nat Rev Microbiol, 2018, 16:143-155.
8.Choi C W, Choi J W, Park K C, et al. Facial sebum affects the development of acne, especially the distribution of inflammatory acne. J Eur Acad Dermatol Venereol, 2013, 27: 301-306.
9.Brandwein M, Steinberg D, Meshner S. Microbial biofilms and the human skin microbiome. NPJ Biofilms Microbiomes, 2016, 2: 3-8.
10.Li Z, Xia J, Jiang L, et al. Characterization of the human skin resistome and identification of two microbiota cutotypes. Microbiome, 2021, 9: 47-66.
本文来自微信公众号:科学杂志1915(ID:kexuemag),作者:夏晶晶 钟倩 魏情珍 王久存
Recommend
About Joyk
Aggregate valuable and interesting links.
Joyk means Joy of geeK