

mRNA简史:25年,从边缘革命到舞台中心
source link: https://www.qianzhan.com/analyst/detail/329/221103-2c98b208.html
Go to the source link to view the article. You can view the picture content, updated content and better typesetting reading experience. If the link is broken, please click the button below to view the snapshot at that time.

mRNA简史:25年,从边缘革命到舞台中心
(图片来源:摄图网)
作者|林晓晨 来源|锦缎(ID:jinduan006)
疫情之下,mRNA疫苗成为全球最大的医药品类。整个2021年,辉瑞的BNT162b2疫苗和Moderna的mRNA-1273疫苗分别创下404亿美元和176.75亿美元的营收,成为全球销售额第一和第三的药物。
在mRNA疫苗的耀眼光辉背后,却鲜有人知晓这项技术的发端与进程。
早在1961年,人类就已经发现了mRNA,但受限于mRNA本身的脆弱性,因此其在很长一段时间中都被业界视为是一种“边缘技术”。不仅布局mRNA技术的企业寥寥,甚至大学中博士研究员都难以拿到项目经费。
如果没有新冠疫情的催化,那么mRNA无疑仍将是医学界的“边缘地带”。
mRNA技术究竟是如何一步步从“边缘”走向“主流”的?这一切还要从25年的一位年青女科学家说起。
01
“破壁者”往事
1985年1月17日,刚过完自己30岁生日的匈牙利生物研究员卡塔琳·卡里科接到噩耗:她因迟迟没有研究成果而被匈牙利科学院生物研究中心解雇了。痴情于mRNA的她原本想在欧洲找到一份继续研究的工作,但遭遇的却是一次又一次的挫败。
最终,卡塔琳在遥远的美国费城天普大学找到了一份工作。她卖掉了匈牙利的汽车,带着1000美元的全部身家飞往美国。就当她以为一切都开始向好发展的时候,却又一次被残酷的现实打脸,来到美国的前四年时间中,卡塔琳被迫换了三份工作,当时mRNA技术鲜有需求,更没有人愿意为它付费。
转折点出现在1989年,卡塔琳成为宾夕法尼亚大学的助理教授,她才真正找到了一份能够稳定研究mRNA项目的工作。但在此后多年,她仍然因为缺乏资金而没有获得任何进展,直至1997年加入同样坚信mRNA技术的免疫学家德鲁·韦斯曼的团队。
当时之所以没有人愿意投资mRNA项目,是因为单链mRNA具有超强的免疫原性,很容易激活人体免疫系统,造成严重的炎症。这就意味着,如果无法解决mRNA的免疫原性,那么它不仅无法成药,甚至还是一剂“毒药”。
mRNA犹如一匹烈马,拥有超强治疗潜力的同时,其也因为“性格”太烈而让投资者望而生畏。
就在几乎所有人都认为mRNA是“死路一条”的情况下,卡塔琳依然坚持自己的判断,并将这份执着贯彻到mRNA结构的研究中。为了找到规避人体“免疫系统”的方式,卡塔琳测试了各种来源不同的RNA,终于在研究转运RNA(tRNA)的时候,发现tRNA并不会引起免疫系统的异常。
进一步抽丝剥茧,卡塔琳发现tRNA的最大特点在于拥有大量的修饰核苷——假尿嘧啶核苷。接下来,卡塔琳开始尝试将假尿嘧啶核苷引入mRNA,最终成功降低了免疫原性。
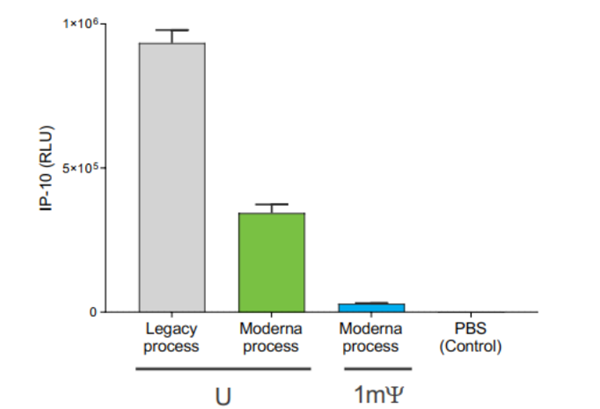
这项惊人的发现在2005年被发表在《免疫》杂志上,通过将尿苷替换成假尿苷,不仅能够有效降低免疫原性,而且还能增强mRNA的翻译效率。
从1980年卡塔琳正式研究mRNA算起,经历25年的坚持后,她终于解决mRNA的免疫原性,使得mRNA这匹“烈马”被人类所驯服。这也被视为mRNA真正成药性的开端。
02
第二重关:如何送入人体
虽然卡塔琳的研究让人体不再像以前那样排斥mRNA,但mRNA想要真正的成为一款药物,依然有诸多难题有待解决——如何将其成功的递送到人体就是挡在mRNA技术前的第二座大山。
人类的DNA想要转化成蛋白质,必须通过mRNA进行翻译,理论上所有蛋白质都可以通过编辑mRNA来获得。基于这样的特性,mRNA有望在预防性疫苗、肿瘤免疫治疗、蛋白质替代疗法以及再生治疗等疑难领域发挥作用。
它的成药原理很简单,就是利用mRNA能够翻译蛋白质的特性,定向翻译出所设计的抗原蛋白,或直接作用,或激发人体自身免疫系统,以此来治疗疾病。

mRNA由单链构成,很容易在人体内发生降解;同时,mRNA想要实现翻译功能必须进入到细胞膜内,但由于mRNA和细胞膜均带负电荷,会产生排斥反应,导致mRNA难以进入。受这些因素阻碍,即使mRNA不会引起免疫反应,但仍难以起到安全稳定的治疗目的。
为了促进细胞对mRNA的摄取,业界开始尝试利用递送系统来辅助。早期的递送系统多为精蛋白和阳离子脂质DOTAP,但这些聚合物大多效果平平,能够成功作用于动物研究的聚合物数量有限。
直至2015年,韦斯曼团队中的一名叫作诺伯特·帕迪的研究员发现,脂质纳米颗粒(LNP)有很大的临床潜力,通过构建mRNA-LNP复合物的方式,可以有效的帮助mRNA进入细胞。在被用于递送mRNA之前,LNP已经被应用于递送小分子药物和很分子量更小的小干扰RNA(siRNA)。
由于LNP的概念过于抽象,我们可以简单的将其理解为一辆运送mRNA的卡车,不仅可以避免mRNA被酶和免疫系统清除,同时由于LNP具有亲脂性,可以在细胞膜内融合,可以在细胞膜内释放mRNA用于后续的蛋白翻译过程。
从结构看,LNP主要由 4 种物质组成:阳离子离脂质,中性辅助脂质,胆固醇,聚乙二醇(PEG)化脂质。阳离子脂质负责与负电的mRNA结合,中性辅助脂质能够在内吞时加快mRNA释放,胆固醇可以稳定LNP的结构,PEG则可以防止LNP的聚集。
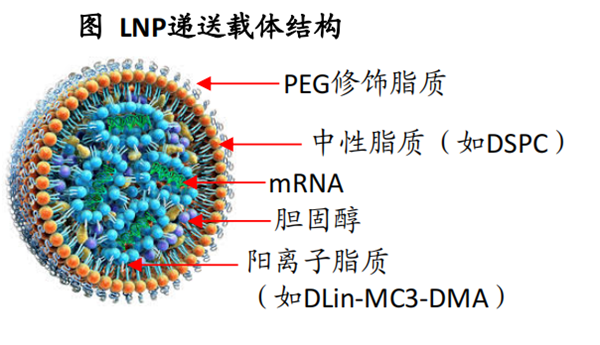
正是基于LNP递送系统的成功,才使得科学家看到了mRNA成药的可能性。目前上市的mRNA疫苗产品,都使用LNP作为递送系统。
在解决了mRNA的免疫原性与递送问题后,mRNA真正的开始进入到成药阶段。
03
中国企业为何举步维艰?
与传统医药技术相比,mRNA应用领域广泛,研发更加高效,生产周期也更短。这些优势让mRNA有望成为颠覆医药格局的下一代技术。
尤其是在突如其来的疫情之下,mRNA的这种高效率优势被发挥的淋漓尽致。在所有的新冠疫苗中,mRNA是进展最快的路线,平均研发周期为0.8-1.5年,工艺生产建造周期为2-4年,遥遥领先于传统技术路线。正是由于mRNA技术能够快速响应,它才一举从“边缘技术”蜕变为“核心技术”。
目前,新冠疫苗是mRNA的唯一场景,且随着疫苗渗透率的持续提升,人们对于新冠疫苗的需求也在不断降低。毫无疑问,下一场mRNA药物的争夺战已经展开,那就是谁能找到除新冠疫苗之外的第二市场。
总的来看,肿瘤依然是mRNA企业的主攻方向,所有正在进行的mRNA临床试验中,有75%的临床是针对肿瘤适应症,HIV病毒、流感、寨卡病毒等传染病则是另一个重点研究方向。

但很可惜的是,除得到“特别照顾”的新冠疫苗外,尚没有mRNA药物成功进入到临床三期,甚至有18%的临床试验因副作用而被终止。平心而论,现阶段人类对于mRNA的了解还并不深入,虽然解决了递送问题,但如何设计mRNA的核苷酸序列依然是一个难点,需要经过大量的迭代试验。
mRNA技术火热背后,我们很少能够发现中国企业的身影,为何国内企业没有布局这项颇具前景的技术呢?核心原因就在专利之上。
正如前文所述,mRNA之所以能够成药,是建立在解决免疫原性和递送系统两大核心问题之上。然而,科学家在核心领域取得突破后,同样的也获得了该领域的核心专利权。
例如卡塔琳团队发现了“假尿苷替换”技术后,他们就很快申请了专利,随后他们所在的宾夕法尼亚大学又将专利授权给Cellscript公司,而Cellscript公司则将专利授权给了Moderna 和 BioNTech。
图:mRNA 分子修饰的关键专利授权情况,来源:国金证券
二者的新冠疫苗中都使用了这项技术,而另一mRNA巨头CureVac则使用了未经修饰的尿苷,最后的结果就是CureVac免疫原性较高,无法使用大剂量,导致最终效果很差。
同样的,LNP递送系统则是另一关键专利。美国公司Arbutus是LNP领域龙头,其在阳离子脂质及 PEG 脂质方面的专利覆盖广泛,三大mRNA公司Moderna、BioNTech和CureVac都曾选择与Arbutus合作获得LNP的授权。不过,虽然LNP递送系统存在一定的专利壁垒,但却并非无可逾越,Moderna就曾因专利纠纷与Arbutus闹翻,最终Moderna选择自研递送系统,而且上市的新冠疫苗 mRNA-1273正是采用自研的递送系统。
对于中国企业而言,之所以在mRNA领域进度慢于海外公司,其核心原因就在于专利限制。如果没有取得相关公司的授权,那么我们就只能通过自研的方式,想办法绕开专利的限制,这一定程度上减慢了我们技术发展的步伐。
现阶段,我国mRNA研发进度靠前的公司,大多是在相关专利领域进行深度布局的初创公司,如艾博生物、斯微生物等。而传统药企往往是通过与具备技术竞争力初创企业合作的方式进行布局,如沃森生物的mRNA新冠疫苗就是与艾博生物合作研发的。
这种合作方式固然能够快速入局mRNA市场,但同时这种合作方式过于松散,彼此之间的合作也并不稳固。沃森生物除与艾博生物合作外,还与蓝鹊生物有所合作,而艾博生物在成为2021年全球生物制药公司融资王后,显然也并不愿意长期担当沃森生物的影子。
作为一种较为新颖的平台技术,mRNA依然需要长期迭代,虽然目前我国企业在这一领域脚步并不快,但他们已经具备了专利预警和避开专利壁垒的意识,相信经过持续迭代,我国企业会在mRNA领域的竞争中越来越好。
对此,我们应该多一些信心:尽管我们依然与国际巨头有不小的差距,好似“身处边缘”,但复盘人类历史,从“边缘”走向“中心”并不是个例,而是十分常见的一般规律。任何新技术和新势力的崛起,多数都诞生于“边缘”,虽然“边缘”不被关注,但却具有惊人的爆发力,只有对“边缘”怀有包容和忍耐之心,持续精进钻研,才能走向“主流”。
正如mRNA经历的那样,“边缘技术”的成功,需要的是持续的努力和一点点东风。
编者按:本文转载自微信公众号:锦缎(ID:jinduan006),作者:林晓晨
Recommend
About Joyk
Aggregate valuable and interesting links.
Joyk means Joy of geeK