

美国心脏病患者接受全球首例猪心移植,供体猪已经过基因改造,这意味着什么?
source link: https://www.zhihu.com/question/510949279
Go to the source link to view the article. You can view the picture content, updated content and better typesetting reading experience. If the link is broken, please click the button below to view the snapshot at that time.

美国心脏病患者接受全球首例猪心移植,供体猪已经过基因改造,这意味着什么?
340 个回答
这是一个有意义的尝试,也希望这个领域能够取得更大的进展,这是真正可以造福人类,甚至某种程度突破人类上限的一种思路。
先解读下这个新闻中的猪心脏移植问题。
——————猪心脏移植之基因改造——————
把猪的心脏移植到人身上,称之为异种器官移植(Xenotransplantation)。
要想实现异种器官移植,需要解决几个基本问题。
1,免疫排斥问题
人和人之间的器官移植尚且会发生免疫排斥,更别提跨物种了。
新闻报道的4个基因被敲除或灭活,根据个人经验,很有可能包括了GGTA1,这个基因是一个α 半乳糖抗原,是异种器官移植中首先需要干掉的,为何?因为这个基因会导致发生异种器官移植超急性排斥反应 (HyperacuteRejection ,HAR),也就是一旦发生这种超急性免疫排斥,人就会迅速死亡。
所以目前我们做异种器官移植,基本上先把这个基因敲掉。
除此以外,我估计还要敲掉其他一些免疫基因,比如抗体基因和补体基因。
目前越过了48小时,基本上过了超急性排斥阶段,后续继续观察。
2,人源化过程
这是另一个问题,就是,要保证这颗心脏安装上去后,能够维持正常的功能,那么往往需要进行基因人源化处理。
也就是用人的基因去替代猪的基因。
否则可能会出现异种移植后,器官本身出现问题,或者移植上去只是一块肉。
因此现在异种器官移植基本上会修改一部分猪的基因,然后才让其可以移植到人身上。
因此,我们可以看到,这个研究中,一共改造了10个基因。
可能对于部分人会觉得,改造几个基因很容易,然而现实中,难度很大。尽管有些研究可以一次性编辑几百上千个基因,但是从我了解的实际中,编辑多个基因难度其实高,所以这个研究还是很厉害的。
——————异种器官移植,一个解决生命的思路———
—————生命之下,其他都是小事—————
其实一直以来,异种器官移植,都面临很多障碍,比如医学上的障碍,免疫问题,操作问题,术后护理问题等,不过, 最让人头大的,是伦理问题。
然而,这些问题,在生命面前,有那么重要吗?
很多时候,我们做出评价或者所谓的选择,其实是在暂时无需做出选择的时候进行的,所以某种程度上,是“事不关己高高挂起”,然而, 真到了那一刻,可能这种问题,根本不是问题了。
器官缺口是最大的问题。
器官短缺是一个全球性问题,尽管全世界都存在器官捐献,但事实上,能够实现的器官移植非常少。
在我国,每年能够顺利完成器官移植的人也就是1万多例,而需要器官的人群缺口高达150万,这个数字,随着未来老龄化的推进,缺口会越来越大。
囿于现实问题,以及医学伦理禁止克隆人的现状,可以预见的未来,克隆人是不可能被允许的。
可以预见的未来,克隆人是不可能被允许的那么,这个时候,异种器官移植事实上就摆在了我们的面前。
对于异种器官移植,其实也不是那么简单。
1, 生物大小要相对匹配
这个其实直接排除了绝大多数生物。可能很多人没意识到,其实自然界中,和人类体型相接近的生物其实并不多,无论是猫狗还是常见实验动物小鼠,和人类体型相差太大(事实上,其他问题也存在,比如鼠的心跳400~500 次)。而大型哺乳动物也存在同样的问题。
2, 器官要相对低廉
这个问题事实上是个很明显的问题,如果一个异种器官极其昂贵,那么其意义就大打折扣,毕竟当今绝大多数人还达不到可以视金钱如粪土的无限使用医疗资源,因病返贫的问题早已是一个现实问题了。
而这种情况下,猪就成为了一个重要来源
1,猪和人类体型非常接近,猪的体重其实和成人大概差不多
2,猪和人类食性一致,代谢相似。
作为一种被人类圈养的生物,猪事实上完全适应了人类的生活,人类的食物猪都吃,且相比马牛羊,猪是杂食性的生物。
3,猪相对低廉。
所以,在搜索引擎上,搜索异种器官移植,你会发现,top全是猪。
相信一定有人会问,灵长类不是和人类很接近吗?为什么不用灵长类?
灵长类是个好的选择,毕竟和人类亲缘关系最近,然而灵长类面临几个问题
1, 价格及其昂贵
以当前实验室为例,一只猴子的成本就已经非常昂贵了。
2,体型相差较大
可能和很多人想法不一样,其实大部分灵长类,和人类体型差异很大。实验室用的最多的猕猴,身高只有50多厘米,也就是大部分人膝盖那么高,体重5-7kg,相当于2个月大小的婴儿。这样的动物,是没法做人类移植的,器官大小匹配度太低。
猩猩是个好选择,但是目前很少有用猩猩做这种研究的。
3, 伦理问题更大
伦理问题是制约灵长类研究的重要因素,甚至可能是主要因素。
事实上, 这次疫情,相信大家也看到了,国内疫苗是研究最快最广泛的,除了因为我们科研实力充足,很重要的因素是,疫苗实验需要的猴子,基本上在中国。
4,灵长类规模不容易扩大
和人类一样,大部分情况下,灵长类不是多胎生物,这就意味着种群规模扩大其实很难。
——————猪器官移植,一个可行的思路——————
其实,猪器官移植,已经取得了不小的进展了,当然,主要是在灵长类上
————心脏移植长达945天的存活————
2016年,通过对猪的基因进行改造,使其进行了三个基因修饰,分别是敲除了GGAT1基因(用于消除移植过程产生的应激性排斥),过表达hCD46(用于解决免疫问题),hTBM(血栓调节蛋白),然后将这颗上基因修饰的心脏移植到了狒狒身上。
结果,狒狒存活了945天,这基本上接近3年的时间了。
这是迄今为止从猪移植到灵长类上移植后存活时间最长的一个记录了。
不仅仅是心脏。
————肾脏移植长达499天的存活————
2019年,美国埃默里大学的研究者同样使用了猪进行异种器官移植,这一次,他们使用的是猪的肾,移植到的是猕猴(Rhesus Macaque)。
同样是对基因进行修饰,分别敲除了GGAT1基因(用于消除移植过程产生的应激性排斥),并过表达了hCD55(人免疫基因CD55,用于降低免疫排斥),此外,还进行了合理的免疫抑制剂方案,比如αCD4和antiCD154联合。
结果,该猕猴存活时间499天。
————不仅仅是普通灵长类,事实上已经有了人类的移植————
国内做的比较强的湘雅医院已经进行了猪胰岛到人类的移植
完成了对10名1型糖尿病患者进行猪胰岛移植临床研究。跟术前比较,患者总体胰岛素使用减少60%以上,最好效果减量90%。根据国际共认的胰岛移植综合评分,平均达到0.62分,最好达到0.88分(完全治愈糖尿病为1分)
事实上具备了临床应用的意义。
除此以外,目前已经进行的异种器官移植包括胰岛、皮肤、角膜等诸多器官。
目前,猪是所有异种器官移植中,进展最快的一种,远远领先其他物种至少一到两个时代。
不过值得注意的是,目前在灵长类是的器官移植能够长期成功地基本上异位移植,换句话,这个器官并没有真正意义上接到原有位置并替代原有器官。
—————未来会如何?———
其实除了异种器官移植,还有其他思路
1,干细胞技术
很有希望的明星技术,但是目前无法培养成器官。
2,3D打印技术
目前需要解决的是如何让一个器官最大程度具备生物学活性。尽管目前已经实现了可以让肺具有一定的自主能力或者心脏能跳动,但是距离器官,非常遥远
3,克隆
其实克隆是最理想的办法,很多人希望用自己的细胞培养出器官,不过遗憾的是,目前我们不具备【单独】克隆某个器官的能力。
一种策略就是让克隆到胚胎阶段发育到成型,然后取器官。然而,这是违法的。
那么,面对“尚未到来”的未来,和活在当下的现在,只能做一个妥协。
异种器官是一个现实可行的策略,本身是来源于动物的活器官,且可以临床实现移植并存活。
那么,在未来到来之前,可能是“唯一策略”。
至于排斥问题、器官寿命问题,这些当然是重要因素,但不是核心因素,毕竟对于很多人来说,延长一天那也是值得的。
2022年1月11日,USA TODAY 发表了一篇科学新闻——全球首例猪心移植手术顺利完成!
马里兰大学医学中心于 2022 年 1 月 10 日宣布,已将“转基因猪心脏”移植到一名57 岁的严重心力衰竭和心律失常的男性患者体内。
手术于1月7日进行,术后患者至少存活3天。参与手术的医疗团队称,目前转基因猪的心脏在患者体内继续发挥功能,不会立即被人体排斥。
我们常见的心脏移植供体都是另外一位因各种原因去世的患者,捐献功能良好的心脏给受体,让鲜活的器官在另外一个身体里继续跳动。为什么这位患者要用猪心来做供体呢?
这是因为由于严重的心力衰竭和心律失常等问题,贝内特已经不适用人类心脏进行移植手术,他在接受手术前已经依靠生命支持系统数月,只能卧病在床等待死神的降临。
2021 年 12 月 31 日,美国食品药品监督管理局 (FDA) 紧急批准贝内特进行猪心脏移植手术,正因此,奄奄一息的贝内特才有机会进行猪源心脏移植。
俗话说,台上一分钟,台下十年功。猪源心脏移植到人体虽然是首例,但是为了这场瞩目的手术,手术团队已经在过去5年开展了大约 50 次“将猪心脏移植到狒狒身上的手术”。
依据这个团队的经验,基因编辑的猪源心脏移植到狒狒体内的手术开展得很顺利,且猪源心脏能够正常工作,维持狒狒的生命体征。
不过,要确定猪心移植到人体后手术是否真正成功,现在下结论还为时过早。
为什么要用猪心做供体呢?
以人类目前的临床技术,心脏移植是晚期心力衰竭患者的唯一选择。
大多数心脏移植的供体都是人类,可以直接避免免疫排斥,同时心脏大小也合适。心脏移植手术目前是一项成熟的技术,我国的心脏移植技术已经位列世界前沿。
每年开展的百例心脏移植手术,不仅延长了患者的生命,提高了生活质量,也让不幸离世的患者用另外一种方式重生,依然和家人以另外一种方式在同一个时空团圆。
然而,世界范围内器官严重短缺,供不应求,可用器官数量无法满足心脏移植的需求,很多心衰患者在等待供体的治疗过程中去世。
因此,心脏移植需要其他可替代的供体来源。
猪的器官,真的能在人身上起作用吗?
答案是肯定的。
猪的生理和器官大小与人类非常相似,与来自牛等其他动物的器官相比,它们的器官更容易适应人体。
多个科研机构开展过手术尝试,都获得了理想结果:
美国国立卫生研究院(US NIH)的研究人员已成功将猪心移植到狒狒体内,并使狒狒存活了两年多。
在德国的另一项独立研究中,研究人员能够给多只狒狒从猪身上移植心脏,所有狒狒都存活了六个月以上。
这些手术后狒狒存活时间数字乍一看似乎很低,但是 ,狒狒的平均预期寿命也远低于人类的平均预期寿命。
从这些研究中,我们可以看到,猪的移植物在理论上和实践上都可以发挥作用,尽管效果不是很好。
猪心换人心,是怎么实现的?
猪和人虽然有大量的相似基因片段,但是猪和人终究是两个完全不同的物种,存在明显的器官异种排斥。
异种排斥(Heterogeneous rejection),顾名思义,就是不同物种之间的器官组织相互排斥。
猪的组织细胞有一个基因可以产生一种叫做 α-gal的糖分子,而人体将 α-gal识别为异物并对其进行攻击,因此将猪器官移植到人体中会引起急性排斥反应。因此,要筛选猪心作为理想的器官供体,就必须要解决免疫排斥的问题。
另外,虽然猪和人的体型差不多,心脏大小很接近,是理想的心脏移植供体,但是猪的心脏会逐渐生长,渐渐不匹配人的身体。因此要控制猪心脏的大小,避免移植后的心脏逐渐长大。
这时候,神奇的基因编辑技术(gene editing)就能派上用场了。
为了能够让供体猪的心脏更适应人类的生理需求,并且长期稳定、安全工作,就要对猪的基因进行编辑。
比如,美国再生医学公司Revivicor开发的“GalSafe猪”通过基因改造不含 α-gal 的糖分子,移植到人体后可防止急性排斥反应。
在2021 年 9 月进行的“将猪的肾脏连接到脑死亡患者身体的手术”中使用的肾脏也取自 Revivicor 公司开发的“GalSafe 猪”。术后,猪源肾脏在该患者皮下顺利存活,无明显免疫排斥。
该手术也是为了后续进行猪源心脏移植手术提供重要参照,但是当时并没有获得很多关注。
同样地,为了能够为患者提供一颗能够正常、安全、持久工作的猪源心脏,这只小猪在胚胎期间就经过了复杂的基因编辑——10种基因编辑 !
10种基因编辑让猪心顺利被人体接纳:
1. 有3种引发人体异种免疫排斥的基因被敲除;
2. 有1种控制猪心脏生长的基因被敲低;
3. 有6种基因编辑到猪基因中,使得猪心与人体相容性更好。
经过10种基因编辑,这颗猪心已经“改头换面”,从此远离了只能摆上饭桌的命运,而是以另外一种方式融入人体。
除了心脏移植,基因编辑猪还能提供其他器官吗?
其实基因编辑猪作为器官来源已经研究了很多年,但是因为伦理和安全问题,一直磕磕绊绊。
根据异种器官移植的发展简史,我们可以了解到:
早在1902-1923年,猪、羊、猴子来源器官进行人体异种移植尝试,全部以失败告终;
1963年,狒狒来源肾移植帮助患者存活19-98天不等;黑猩猩来源肾移植帮助一位患者存活9个月,但是同时开展的其他12位患者并没有这么幸运;但是这个尝试鼓励了心脏移植;
1964年,首例动物来源心脏移植后,患者仅存活2小时;
1983年一名新生儿接受狒狒来源心脏移植后存活20天;
1995年,一名HIV患者接受了狒狒骨髓移植,但是2周后死亡;
1996年,猪源细胞移植用于治疗糖尿病;
1997年,由于伦理问题和动物保护协会抗议,全球禁止任何机构开展异种器官移植;
2000-2011年,全球部分地区颁布条例允许开展异种器官移植研究。
除了心脏移植,基因敲除的猪还能够提供其他器官帮助患者恢复健康,包括肾脏、肝脏和肺,其他的还有胰腺和角膜。
在全球各地,都有建立基因敲除猪的研究所,都是为了能够推进猪源器官异种移植为缓解目前器官短缺的困境。
(图源technologyreview,金屋藏“猪”)
湖南省异种移植工程技术研究中心是全球第二家医用级(DPF)供体猪培育中心。
(图源见水印) 在供体猪培育中心,猪猪们过着这样的精致生活:
供体猪的住所约有1500平方米,里面生活着100多头猪,室温常年保持在22℃~26℃,其洁净程度堪比无菌手术层流室。
为了避免猪喝水时唾液接触出水口带来的污染,所有的出水口都带有自动感应装置,里面的饮用水都是经过反渗透技术处理后的纯净水。
尽管处在无菌的空间里,供体猪每周仍要洗一次澡。它们吃的也不是普通猪食,而是特殊配方的“营养餐”,并且一天只吃两顿,让其保持苗条体形,体重保持与人类接近的50~60公斤。
想不到吧,猪猪全身都是宝!
其实,换心、换头手术并不是新鲜事,很久之前,医学界就曾掀起过「换头狂潮」。
死而复生,自上古时代便是人类的终极幻想之一。
当死亡降临,意识归于无尽的深邃黑暗之中,呼吸、心跳、脉搏纷纷消失,四肢逐渐冰凉之后,还有可能让这具已逝的躯体,重新复活吗?
本文将要分享的,不是《科学怪人》那样的哥特狂想,而是一群现实版的弗兰肯斯坦,他们都有一个共同的特点,以当时最激进的思维,最前沿的科技,外加一些最狂野的脑洞,创造出了人类医学史一个又一个的奇迹,也沉陷于无尽的批判之中……
1947 年,全美国最戒备森严的加州圣昆廷监狱里,重刑犯托马斯·麦克默尼格尔(Thomas McMonigle)向狱警提出了一个匪夷所思、闻所未闻的要求。
两年前的一个寒冬,这个 30 出头的长脸男人开着轿车,停在一群女中学生旁边,并以招人做工之名哄骗其中一位女孩上了车。
只有 14 岁的单纯姑娘索拉不会知道,车上这个男人将带给她怎样的噩梦……麦克默尼格尔驱车开往加州边远的北部,并在途中将索拉凶残地杀害了。
事发之后,警方很快便锁定了这个臭名昭著的嫌犯——早在 13 年前,麦克默尼格尔便曾因为强暴未遂入狱 9 年,获释一年之后,又因袭击高中生而被捕。
就在索拉遇害之前,他还刚刚谋杀了另一个姑娘琼斯。
仅仅耗时 38 分钟,陪审团便一致裁定麦克默尼格尔罪不可恕,并将对其处以极刑——毒气室伺候!
得知大限将至,杀人魔头吓得浑身如筛糠一般……轻易践踏别人生命的他,此时却对自己生命的终结极为恐惧。
他深知自己罪孽深重,再无上诉改判的可能,可强烈的求生欲又煎熬着他懦弱的心灵……就在走投无路之际,他猛然想到了一个男人,或许,此人能给他一线生机?
这个男人,名叫罗伯特·寇尼什(Robert Cornish),是上世纪 30 年代闻名全加州的一位奇人。
年仅 18 岁时,寇尼什就已经从加州大学伯克利分校毕业,22 岁就念到了博士,毕业之后的他,开始专注于生物领域的研究,并逐渐对死而复生产生了浓厚的兴趣。
经过一系列的研究,寇尼什开发出了一架装置,由真空吸尘器、鼓风机、散热器管、铁轮和玻璃管构成,并组合为跷跷板的模样。
接下来,他又找到五只梗犬,并将它们全部命名为「拉撒路(Lazarus)」。在《约翰福音》11 章的记载中,拉撒路是耶稣的门徒,并在病死后的第四天奇迹般地复活了。
备齐一切前置手续后,寇尼什在加州大学一间阴暗的旧建筑中,开始着手自己的实验。
他先是利用乙醚和氮气将「拉撒路」窒息死亡,在确认心跳和呼吸停止并计时六分钟之后,再将尸体绑在他的「寇尼什跷跷板」装置上。
随后,他切开梗犬大腿的静脉,将自己独家研制的「复活药剂」注射进去。
在寇尼什发表的论文中可以获知,这种「复活药剂」是一种含氧饱和的生理盐水溶液,其中还添加了很多他认为很关键的成分,比如:心脏兴奋剂、肾上腺素、肝脏提取出的肝素、以及一些去除了纤维蛋白(凝固物质)的狗血,嗯,这真的很狗血了……
注射完毕之后,寇尼什对着狗嘴用力吹了一口气,接着便开始大力地摇动那个跷跷板装置,让「拉撒路」在上面反复晃动。之所以费这么大劲,目的就是为了让「复活药剂」能够迅速渗入到它的体内,以刺激血液循环。
或许你很难相信,这看似荒谬的表演却真的起到了效果,「拉撒路」的自主呼吸猛然恢复了,它倒抽了一口凉气,后肢抽搐了一下,出现了微弱的脉搏……紧接着,这只死掉的梗犬居然恢复了心跳——它真的复活了!
然而,「拉撒路」死而复生之后的状态,却相当不乐观。
它一直处于半睡半醒的昏迷状态,没有清醒的神智,不住地喘气、吠叫,还动不动就发出一两声哀嚎。寇尼什尝试增进它的血压,并注射了一些葡萄糖溶液,没想到,这一举动反而令这只梗犬彻底断了气。
随后的数次改良尝试里,寇尼什又一次完成了「死而复生」的实验,令另一只「拉撒路」成功复活,虽然存活的时间依然短暂,而且它失去了视觉,但这次实验依然被誉为医学上的巨大成功。
就这样,寇尼什一炮而红了,媒体开始疯狂地报道他的科研成果, 1935 年环球影业还上映了一部以他为原型的科幻片《生命归来》(life returns)。
死而复生实验不仅成为人们茶余饭后的谈资,还引来了许多富人的关注,其中不乏一些表示愿意投资的土豪。
名利双收的寇尼什,决定进入下一阶段的禁断计划:人体死而复生。唯一的问题是,该找谁来当实验品呢?他想到了一个绝妙的主意——死刑犯。
为了让受试者可以顺利进行试验,他改良了原先的跷跷板,将其加大加宽以保证可以容纳人类尸体,又在四肢部位安装了加热垫。复生过程的设计也更加复杂,首先需要将一种称为「亚甲蓝」的化学物质注入死者静脉,以中和毒气室内致死的物质(当时的死刑主要是借助毒气);接下来,还要通过面罩将纯氧泵入肺部;最后才是摇晃跷跷板,让死者的血液恢复循环。
正是听闻了寇尼什的新计划,令变态杀手托马斯·麦克默尼格尔在进入毒气室之前,想到了这根最后的救命稻草。他给寇尼什写了一封言辞恳切的信,希望在死刑执行后能够进行死而复生实验,自己甘当人类实验品,奉献给科学界……
显然,这些冠冕堂皇的话的背后隐藏着真正目的——麦克默尼格尔的律师告诉他,根据现行法律,只要他能够顺利地死而复生,就可以重获自由。
不过,杀人魔头的妄想终究还是破灭了。时任圣昆廷典狱长的克林顿·达菲(Clinton Duffy)断然拒绝了这一提议,加州法院也「从中作梗」,宣布死刑程序不得更改。
麦克默尼格尔最终被送进了毒气室,而寇尼什的人体复活实验也遭遇了一系列滑铁卢,心灰意冷的他宣布无限期搁置人类尸体复活计划。
然而,对于死而复生的探索并未就此结束……就在几十年后,当时的另一个超级大国苏联,也有一些科学家开始了对死而复生的深入研究。
相比起不疯魔不成活的寇尼什,他们的研究显然严谨得多,也专业得多……
1939 年,苏联实验生理学和治疗研究所里,年近半百的谢尔盖·布留霍年科(Sergei Brukhonenko)正在全神贯注地进行一项鲜为人知的实验。
这位斯大林时代苏联最杰出的生物医学专家或许不会知道,一年之后自己的研究将会带给医学界怎样的震撼……
即便以今天的视野来看,布留霍年科的实验内容也堪称骇人听闻:他先是将一只实验用牧羊犬的心脏取出,悬挂起来,并迅速将数根管子紧密接入这颗心脏的血管,其中一部分管子会连接到一个外型奇特的装置之上,而单独一根管子则插入一罐血液中。显然,这些新鲜的血液来自同一只牧羊犬。
与此同时,那只牧羊犬的右侧肺脏也会被取出并置于托盘上,它也会被连接上波纹管,并与刚刚的那台装置相连接。
此时你会看到这样的一幅景象:一颗悬垂于空中的心脏,不断砰砰跳动着;而它不远处的一片肺叶,则在一起一伏地运作,这些完全暴露在空气中的器官竟如同在生物体内那样充满了生命力。
然而,这还远不是最诡异的部分——那只牧羊犬的头部也被布留霍年科切除了下来,成为一个独立的实验品。此时这枚孤零零的脑袋与四根管道连接着,看似与肉铺上插标卖首的狗头无异。
此时,实验助理取来一把榔头,并用力地在试验台上敲击了一下,不可思议的一幕发生了:那只狗头居然被吓了一大跳,眼睛圆瞪,嘴巴张开,流露出惊骇的神情。
难道说,将一只狗的头切下来,再把心肺这样重要器官单独取出,在体外供养着,还能继续维持它的生命吗?
没错,至少布留霍年科便是这样想的,这在那个年代绝对属于前无古人的想法。
为此,他发明了一台名为「自动射流器(autojektor)」的装置,它的主体部分是两个电动的隔膜线性泵,分别起到生物体静脉和动脉的作用,再借助储水器来交换氧气。
当自动射流器运转后,会从实验对象体内抽取血液,并将其存放在玻璃器皿中,再对其进行加热和充氧,然后泵回生物体内。
这台精密又前卫的仪器,完美地展现出了彼时苏联生物学的先进——既充满了大胆而激进的想法,又有着严谨缜密的设计感。它第一次真实地展示人工进行的哺乳动物体外循环。
最终,这只以极端方式存活的牧羊犬,维持了大约四个多小时的寿命。而导致它命运终结的原因,仅是因为那台自动射流器装置缺乏良好的密封性,导致血液慢慢在空气中凝固了,无法顺畅地输入。
在四个多小时的「余生」之中,这只狗头不仅会对声光等外部刺激做出明确的反馈,甚至还吞下了放进它口中的一块奶酪,当然……随后这玩意从它断开的食道中滚落了出来……
在总结了这次实验的得失之后,布留霍年科又做了一件更大胆的尝试:他找来了另一只牧羊犬,将其麻醉之后,再将全身的血液抽干,灌入一个密封的玻璃器皿中,同时密切监测脉搏和心跳。
随着血液大量的流失,这只牧羊犬的脉搏和心跳都逐渐趋于减缓,并最终停止。从生理学范畴来说,这只狗儿可以认为已经死去了。
接下来,布留霍年科的助手等待了整整 10 分钟,然后将这只停止心跳的狗儿接上了自动射流器,伴随着机器的运转,抽出的血液缓缓重新流入了这只牧羊犬的体内,在压力的作用下流淌进了它的动脉和静脉血管之中。
数分钟之后,奇迹发生了……
牧羊犬的心脏居然重新开始跳动,它的血液循环系统也随之被激活,脉搏重归了正常的节律。紧接着,自主呼吸也恢复了。当玻璃器皿中的血液被全部泵回牧羊犬的体内后,助手们将自动射流器关闭并移除。
通过十天的恢复,这只经历死亡的牧羊犬居然又活蹦乱跳了起来,过起了健康自如的生活。
按照布留霍年科论文中的说法,这是第一次成功地进行了「生物体死而复生的实验」。此后他又使用这种方法「复活」了数只狗,其中还有一只是曾被「复活」过的双亲的后代。
用今天的医学理论来看,或许布留霍年科并没有做到真正意义上的「死而复生」。可是在过去,生物体失去了心跳、脉搏、呼吸等基本体征,且持续一定时间,就可以被视为死亡。
因此,布留霍年科的研究,的确帮助医学界再一次重新审视死亡的标准,并逐渐将脑死亡视为比心脏死亡更可靠、更科学的死亡准则。
当布留霍年科的实验公之于众后,另一位苏联顶级科学家对此大受震撼,并开始着手一系列更为疯狂的生物实验。十多年后,他的研究终见天日,其令人匪夷所思的程度,更是远远超越了他的前辈……
这位疯狂科学家的名字,叫做弗拉基米尔·德米霍夫(Vladimir Demikhov),是器官移植学的开山祖师。
幼年丧父的他,从小和母亲生活在伏尔加格勒地区北部的一个小农庄里,正是在这里,他和那些牲畜有了许多亲密接触的机会,并逐渐对动物的循环系统产生了浓烈的兴趣。
而前辈巴甫洛夫对犬类的一系列实验,更是给了他很大的启发。
1937 年,德米霍夫制造了医学史上第一颗人造心脏,并将其植入了一只实验用犬体内。随着二战的爆发,他应征入伍加入红军,担任前线的法医和病理学家,还曾来到中国协助抗日。
战争结束后,德米霍夫致力于器官移植的尝试,并成功实现了哺乳动物的心肝肺等器官的移植。
在上世纪 4、50 年代,德米霍夫的移植手术无疑是全球最前沿的,但他的探索欲并不满足于此,而是寻求一个艰难数倍的挑战——哺乳动物的头部能够移植吗?
布留霍年科的实验,带给德米霍夫极大的启发,那颗孤立生存的狗头意味着它可以脱离身体而存活,那么……有没有可能移植到其他同类的身上呢?如果连头部也能被移植的话,那么死去的人是否也能通过移植一颗「活人的头」,来延续生命呢?
德米霍夫决定开启这个疯狂的尝试。1954 年开始,他和同事进行了多达 23 次头部移植手术,其中最令人震惊的一次实验,被他发表了出来。
这次实验的对象,是两只狗,一只是德国牧羊犬「流浪汉」,另一只则是小型犬「沙卡」。
德米霍夫先是将是「沙卡」前腿以下的部位全部截肢,只保留头颈和前肢,再采用布留霍年科的自动射流器技术为其供氧,维持生命体征。
接下来,德米霍夫再将「流浪汉」的颈部切开一个相应的切口,然后把「沙卡」的头颈移植到这个切口上。不得不说,再当时来看这项工程是相当艰难的:实验者首先要用塑料绳索把「沙卡」的颈骨固定在「流浪汉」的脊椎骨上,然后还要进行复杂的血管重建,以确保宿主犬的血液能够供给移植犬。
三个半小时的手术结束之后,又经过了一整天的恢复,一头史无前例的「双头犬」终于诞生了……
哪怕放进怪兽片里,这只「新物种」的模样也毫无违和感:双头狗的每一个脑袋都能独立地运动,且都拥有着听觉、嗅觉、视觉、味觉,但这个怪异生物的两个意识显然不是共通的——位于上端的「沙卡」更像是一个寄宿在「流浪汉」肩上的客人,它只能被高高驮着四处游荡,没有自己控制下方身体的可能。

讲下转基因猪心降低免疫排斥的策略:
用于移植到人体的猪心,首先敲除了猪GGTA1、CMAH、B4GALNT2和SLA四个基因,敲除了猪的“抗原糖链条形码”和免疫识别基因,让人体认不出这是猪心;又在猪里面加入多个 人体免疫抑制基因,降低免疫排斥;最后使用的是无PERV的猪,也就是没病毒的猪,更安全。
具体来说说原理:
人体对猪心一定会有免疫排斥。一旦人体发现这是猪的细胞,不是我自己的,就把猪细胞杀死了。如果让人体识别不了“我”和“非我”,猪心就可以蒙混过关。
细胞识别“我”和“非我”,主要靠两点:
一.是细胞蛋白或脂类上有糖链,一种糖链条形码,是证明是“猪”还是“人”的标志之一。这些条形码有不同糖基化修饰,比如α-1,3-半乳糖苷修饰、N-羟乙酰神经氨酸修饰、β1,4-N-乙酰氨基半乳糖修饰等等,它们有不同糖基化组合,形成了丰富多样的糖基化条形码,区分“我”和“非我”。最常见的抗原譬如说Galα1-3Galβ1-4GlcNAc-R,这个抗原中就有α-1,3-半乳糖苷修饰。
细胞蛋白的糖链修饰,是识别“我”和“非我”的条形码之一二.是细胞表面有信息递呈系统,把糖链条形码扫给免疫细胞。细胞有一种叫作组织相容性复合物MHC I的蛋白,可以看作手机,把糖链条形码和多肽条形码扫一扫,就能扫给免疫细胞,如果发现不是自己的细胞,就开始免疫排斥。
MHC I是细胞表面一类蛋白,将抗原递呈给免疫细胞1. 这次的猪心,首先去除了猪的糖链条形码:
先敲除了GGTG1,使细胞无法形成含有α-1,3-半乳糖苷的糖链,就没法形成带这个修饰的糖脂和糖蛋白。由于这个修饰特别重要,人体识别它的抗体占人总抗体的1%,敲掉这个修饰能大大降低人、猪免疫反应。
但是这样够吗?
远远不够,光敲除GGTG1的猪心移植到猴子身上只能坚持几周,随后还会因免疫排斥而移植失败。
所以,又敲除另外两个糖链修饰基因:
一个是CMAH,在糖链上加上N-羟乙酰神经氨酸修饰。一个是B4GALNT2,在糖链上加上β1,4-N-乙酰氨基半乳糖修饰,它们也构成了糖链条形码的一部分。
当这三个基因敲除后,猪的糖链条形码会进一步被削弱,导致人体不太能识别出这是猪心。
2. 把递呈抗原信息的蛋白敲除了:
细胞表面的糖链能让人分清人和猪,但一些细胞内部的抗原蛋白,要传递到细胞表面才能被人体免疫细胞识别。
这里有一种蛋白叫第Ⅰ类猪白细胞抗原(SLA),放在人身上类似于MHC Ⅰ,用于把蛋白和糖链条形码递呈给免疫细胞,就好像一部扫条形码的手机。
现在把SLA也敲掉了,没法向免疫细胞递呈条形码,让人体尽可能不认识这是猪心。
就这样就结束了吗?
3.还在猪中表达多个人体免疫抑制基因,降低免疫排斥。
会免疫排斥,过表达点免疫抑制基因就可以了。
我没查到这次的转基因猪心插入了哪些免疫抑制相关基因。但有一张NEJM的免疫抑制基因表,免疫抑制基因基本就在这里面。
在猪中插入这些基因,可以进一步降低免疫排斥。
4. 使用了无PERV的猪,更安全:
猪的基因组往往会插入一种叫PERV的病毒基因,PERV是猪的HIV。基本所有的猪都有PERV,这种猪没法移植到人身上。
所以这里用了没有PERV的猪。
有两种方法可以得到这种猪:
一种是把猪基因组里的PERV敲除,但是一头猪往往有几十个拷贝的PERV,敲除又涉及到大规模基因编辑,有安全性问题。
另一种是交配,不断选PERV更少的猪出来,最后可以得到没有PERV的猪。国内目前就有用这种方法得到的猪。
不知道这次的无PERV供体猪是哪种,但很可能是基因编辑猪。
总结:
用于移植到人体的猪心,
首先敲除了猪GGTA1、CMAH、B4GALNT2和SLA四个基因,敲除了猪的糖脂和糖蛋白上的糖链条形码 和免疫递呈基因,让人体认不出这是猪心;
又在猪里面加入多个人体基因,抑制免疫;
最后使用的是无PERV的猪,也就是没病毒的猪,更安全。
由此得到了可以用于人体移植的猪心。
具体关于技术的分析各位大神都写的很详细了。
不再班门弄斧。
从临床的角度说一下我的看法:
首先,这是人类历史医学史上一次很大的尝试与进步。即使最后的结果不成功,也不能抹杀这一步的意义。
在当今同源供体不足的情况下,为很多晚期心衰患者提供了新的解决思路。
而猪的心脏在形态功能上和人类有很大的相似度,其中,猪的主动脉瓣瓣膜作为最主要的供体用于生物瓣的制造,在临床上已经有了40多年的使用经验。
美敦力公司生产的生物瓣膜,就是猪的主动脉瓣,在临床的应用已经超过了40多年。其次,当今心衰的替代治疗方案有很多种,此类技术的成熟以及优势的判定还有很长的路要走。
当今,心衰的外科治疗,比较成熟的方案有同源的人体心脏移植、心室辅助装置的应用,以及最近刚刚通过临床应用的人工心脏等等,各种技术的发展都可以用突飞猛进来形容。
而心室辅助的发展更是让人觉得不可思议,在一些国家,患者5年的生存率已经超过了心脏移植,本来作为心脏移植的过渡期的替代方案,一跃成为主流的治疗方案。不可不说这是很大的进步。
而杜克大学刚刚应用于人体的人工心脏,未来的前景同样值得期待。
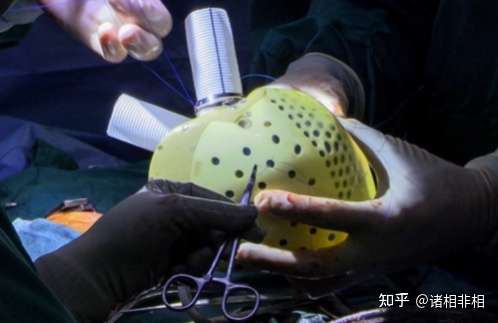 2020年,杜克大学成功植入了第一例全人工心脏
2020年,杜克大学成功植入了第一例全人工心脏而这个崭新疗法的出现,同样面临着很大的挑战,比如器官排异的问题、后续血流动力学匹配性的问题等等。据说患者目前仍没有脱离ECMO的辅助,所以面临着很多的未知,仍有太多的问题值得我们探索。它是否能代替同种心脏移植,甚至是否可以取代心室辅助,这都面临着很多疑问。
而我觉得,其实我们没有必要紧紧盯着这种看似尖端的前沿技术,因为现有的技术仍有很大的提升空间,比如左室辅助等等,把这些问题优化,其实就可以为我们的民众做出很大的帮助和贡献。
第三,这样的新闻能让我们切实感觉到我们与发达国家的差距。
很多大神都分析了这次异种移植面临的技术难题,这可不单纯是把心脏放在胸腔里这么简单,中间经历了基因改造等等一系列技术上的壁垒攻破。而尖端的医疗究竟极限在那里,我们真的需要好好认识。
而所谓的国内顶级,距离这些的差距之大,可不像一些主流媒体吹嘘的那般“不过尔尔”。
当然,这项技术的革新同样面临着伦理等问题的巨大挑战。
总结来说,是一个很了不起的新闻!
但新的技术不代表着就是最好的技术。我觉得说具体意味着多大的进步,目前也无法定义,需要随着时间看看会遇到什么问题而且我们如何克服它;
而对于务实的我们而言,学好现有的成熟的技术,并努力革新并优化他们,把现有的东西(比如左室辅助),做的比国外效果更好,更有发言权;能更好地服务于广大心衰患者,比盯着这样的技术更有实际意义。
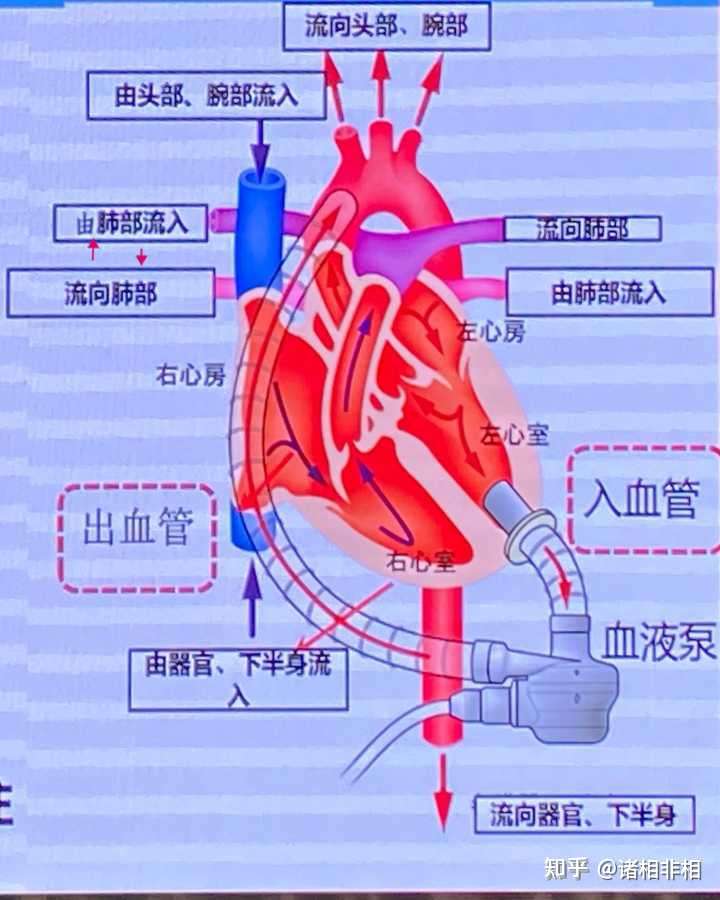 左室辅助示意图
左室辅助示意图Recommend
About Joyk
Aggregate valuable and interesting links.
Joyk means Joy of geeK